El equilibrio ácido-básico es un proceso complejo en el cual
participan múltiples órganos para mantener relativamente constantes una serie de
balances interrelacionados, tales como: pH, equilibrio eléctrico, equilibrio
osmótico y volemia.
Si se producen cambios en alguno de estos elementos, la
respuesta del organismo será tratar de volverlos a sus límites normales,
afectando en un mínimo a otros equilibrios.
HIDROGENIONES.
La concentración de hidrogeniones (H+) en los
líquidos del organismo es una de las variables biológicas más estrechamente
controladas. Esto se debe a que la producción de estos iones por el metabolismo
es cuantiosa.
Cambios relativamente pequeños en su concentración
pueden producir trastornos graves en múltiples órganos y enzimas: un aumento en
la concentración de H+ que se traduzca por una caída del pH por bajo
de 7,20 produce depresión del SNC, disminución de la contractilidad cardíaca,
disminución de la respuesta inotrópica miocárdica a catecolaminas, hiperkalemia,
arritmias, etc.; y si cae a 6,9 es incompatible con la vida. Un pH sobre 7,55
causa serios trastornos y sobre 7,8 lleva a la muerte.
MOLÉCULA.
A los efectos pretendidos, comencemos por definir el concepto de “molécula”, para, después, entrar a recordar el valor de una Gasometría arterial, que es una prueba relativamente sencilla, la cual, sin embargo, tiene importancia clínica de relevancia.
Y es que el "equilibrio ácido-base" puede alterarse por dos tipos de
mecanismos fundamentales.
a) Por cambios en la función respiratoria, con aumento o
disminución de la Presión arterial del Carbono (PaCO2) y, por lo tanto, del Ácido carbónico (H2CO3).
b) O por cambios en la concentración plasmática de hidrogeniones (H) por alteraciones no respiratorias, llamadas corrientemente "metabólicas".
b) O por cambios en la concentración plasmática de hidrogeniones (H) por alteraciones no respiratorias, llamadas corrientemente "metabólicas".
En consecuencia, existen cuatro tipos básicos de trastornos:
-acidosis respiratoria
 -alcalosis respiratoria
-alcalosis respiratoria -acidosis metabólica
-alcalosis metabólica.
Pueden producirse, además, alteraciones mixtas, en las que
hay combinación en grado variable de alteraciones respiratorias y metabólicas.
En todos estos trastornos ácido-básicos está involucrada la ventilación
alveolar: en las de tipo respiratorio como determinante primario y en las
metabólicas, como mecanismo compensatorio.
En cuanto a la denominación de los trastornos, es importante
distinguir la acidosis de la acidemia y la alcalosis de la alcalemia.
Acidemia o Alcalemia se refieren a la existencia en la
sangre de un pH fuera de los límites normales de 7,36 a 7,44. En cambio,
Alcalosis y Acidosis se refieren al trastorno fisiopatológico global en que se produce un cambio en el equilibrio entre Ácidos y Bses en el organismo, con o sin
alteración del pH. Por ejemplo, si bien en la mayoría de los casos una
Alcalosis respiratoria va acompañada de Alcalemia, el pH puede ser normal en
los casos leves si coexiste una Acidosis metabólica o si hay una compensación
completa. Queda claro que sólo eL pH es insuficiente para precisar la
naturaleza de estos trastornos, siendo necesario contar con información sobre
otros componentes de Equilibrio Ácido-base y con datos clínicos.
En la mayoría de los casos de trastornos del Equilibrio
Ácido-base es posible distinguir dos
fases:
a) una aguda,
durante la cual están operando sólo las compensaciones que pueden actuar
rápidamente.
b) una crónica,
en la cual todos los mecanismos compensatorios están funcionando plenamente.
HALLAZGOS DE LABORATORIO EN LAS ALTERACIONES DEL EQUILIBRIO ACIDO-BÁSICO:
ACIDOSIS METABÓLICA:
PH
|
PCO2
|
CO3H2
|
EXCESO DE
BASE
|
COMPENSACIÓN
|
CAUSAS
|
BAJO
|
BAJO
|
BAJO
|
BAJO
|
Alcalosis
Respiratoria
(Hiperventilando)
|
*Diarrea.
*I.Renal.
*Cetoacidosis diabética.
|
ACIDOSIS RESPIRATORIA:
PH
|
PCO2
|
CO3H2
|
EXCESO DE
BASE
|
COMPENSACIÓN
|
CAUSAS
|
BAJO
|
ALTO
|
ALTO
|
ALTO
|
Alcalosis metabólica(disminución de la excrección renal
de Bicarbonato)
|
Hipoventilación
|
ALCALOSIS METABÓLICA:
PH
|
PCO2
|
CO3H2
|
EXCESO DE
BASE
|
COMPENSACIÓN
|
CAUSAS
|
ALTO
|
ALTO
|
ALTO
|
ALTO
|
Acidosis Respiratoria
(aumentando la PaCO2
|
*Vómitos.
*Antiácidos.
*Disminución del K.
|
ALCALOSIS RESPIRATORIA:
PH
|
PCO2
|
CO3H2
|
EXCESO DE
BASE
|
COMPENSACIÓN
|
CAUSAS
|
ALTO
|
BAJO
|
BAJO
|
BAJO
|
ACIDOSIS
METABÓLICA
(Disminuyendo la secreción de
ácidos/disminuyendo la reabsorción de (HCO3-).
|
Hiperventilación
|
MECANISMOS CAUSALES.
 |
| El aparato respiratorio es el encargado de captar OXÍGENO (O2) Y eliminar el DIÓXIDO DE CARBONO (CO2) procedente del metabolismo celular. |
La concentración de Ácido carbónico (H2CO3), en la
reacción de Henderson-Hasselbach, es directa y exclusivamente dependiente de la Presión arterial de carbono (PaCO2),
que, a su vez, depende
de la ventilación alveolar. En cambio, la concentración normal de 24
miliequivalentes/litro (mEq/L) del ión Bicarbonato (HCO3- ) puede variar tanto por
mecanismos respiratorios como metabólicos:
a)
Por cambios respiratorios o de la PaCO2.-
Consideremos la siguiente ecuación: CO2 + H2O = H2CO3
= H+ + HCO3-
-Un aumento de Presión
arterial de anhídrido carbónico (PaCO2)
desplaza el equilibrio hacia la derecha y, al mismo tiempo que aumentan los
hidrogeniones (H), también aumenta la concentración de Bicarbonato (HCO3-
).
-En una disminución
de la Presión parcial de anhídrido carbónico (PaCO2) se produce el efecto contrario.

En cualquiera de estas situaciones existe, por equilibrio
químico, una variación paralela de HCO3- y PaCO2.
Si la PaCO2
vuelve a su valor normal de 40 mmHg, el Ácido carbónico (H2CO3) bajará a
1,2 mEq/L (40 x 0,03) y la concentración de Bicarbonato (HCO3-) también volverá a los 24 Miliequivalentes/Litros (mEq/L) normales.
b) Por cambios no respiratorios o metabólicos
En un paciente que, por una diarrea profusa, por ejemplo,
pierde gran cantidad de HCO3-
en sus deposiciones. Se produce una disminución metabólica o no
respiratoria del Bicarbonato (HCO3-), que no depende ni guarda relación con cambios en
la PaCO2.
Aunque este paciente mantuviera su PaCO2 normal de 40 mmHg, su HCO3- será inferior a lo normal.
Nos podemos encontrar con un “pH” normal; o con un pH que
nos diga que estamos en presencia de una ACIDOSIS, que puede ser de tipo
Respiratorio o Metabólico; o con una ALCALOSIS, también de tipo Respiratorio o
Metabólico.
Acidosis o Alcalosis es lo que debe preocuparnos; y la única
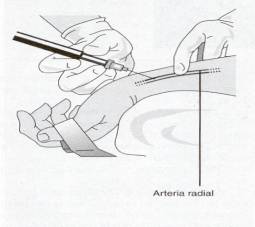
forma de saberlo con cierta seguridad es a través de una Gasometría arterial,
que es un procedimiento relativamente sencillo, ya que puede extraerse esa
sangre de una arteria radial o femoral, fundamentalmente.
Un dato.- Debe procurarse realizar el procedimiento por
dos personas: una hace la extracción y otra se preocupa de ejercer la
suficiente presión sobre esa arteria como para mantener la circulación, al
tiempo de no permitir que la sangre salga de la misma.
La prueba se utiliza para determinar el pH de la sangre, la Presión Parcial de
Dióxido de Carbono (paCO2) y Oxígeno (p2O2), y el nivel de
Bicarbonato ((HCO3). Muchos gasómetros también ofrecen datos de las concentraciones de
Lactato, Hemoglobina, Electrolitos diversos (Sodio, Potasio, Calcio y Cloro),
Oxihemoglobina, Carboxihemoglobina y Metahemoglobina.
El Lactado se produce constantemente durante el METABOLISMO y sobre todo durante el ejercicio, pero no aumenta su concentración hasta que el índice de producción no supere al índice de eliminación de lactato. El índice de eliminación depende de varios factores, como, por ejemplo: transportadores monocarboxilatos, concentración de LDH y capacidad oxidativa en los tejidos. La concentración de lactatos en la sangre usualmente es de 1 o 2 milimol (mmol/l) en reposo, pero puede aumentar hasta 20 mmol/l durante un esfuerzo intenso.
ADENTRÁNDONOS EN EL ASUNTO.
Adelantamos, ¿qué es una Molécula?
Las moléculas están hechas de ÁTOMOS de uno o más ELEMENTOS.
Algunas moléculas están hechas de un sólo tipo de átomo. Por ejemplo, dos
ÁTOMOS de oxígeno se unen para formar una MOLÉCULA de Oxígeno (O2), la parte
del AIRE que necesitamos para respirar y vivir. Otras moléculas son muy grandes
y complejas. Por ejemplo, las moléculas de PROTEÍNA contienen CIENTOS DE
ÁTOMOS.
Está formada por “GRUPOS” de átomos unidos. Los átomos que
se encuentran en una molécula se mantienen “UNIDOS” debido a que “comparten” o
intercambian electrones.
Cada átomo tiene un pequeño pero pesado NÚCLEO central. Una
nube de minúsculos y rápidos ELECTRONES
orbita alrededor del núcleo. El núcleo contiene uno o más PROTONES. Usualmente también tiene NEUTRONES. La mayoría de las
veces hay la misma cantidad de ambos. Un átomo "normal" que no tiene
carga eléctrica tiene el mismo número de ELECTRONES (cargados NEGATIVAMENTE) y PROTONES
(cargados POSITIVAMENTE).
CONCENTRACIONES DE GASES.-
Las concentraciones de gases en la sangre proporcionan los
parámetros plasmáticos para evaluar la función respiratoria del cuerpo y su
equilibrio ácido-base.
VENTILACION ALVEOLAR
En un adulto joven, el Volumen corriente (VC) normal es de alrededor de 500 ml. Sólo una parte de este volumen llega a
los alvéolos, ya que alrededor de 130-160 ml quedan en las vías aéreas y no
participan en el intercambio gaseoso. Este último volumen se denomina espacio
muerto anatómico. Existen, además alvéolos, como los de los vértices, que aun en
condiciones normales tienen un flujo sanguíneo nulo, por lo que tampoco
participan en el intercambio gaseoso. El volumen ocupado por estos alvéolos no
perfundidos se denomina espacio muerto alveolar (normal 20-50 ml). El conjunto de
los espacios muertos anatómico y alveolar se llama espacio muerto fisiológico
(VEM).
Si se multiplica el Volumen corriente (VC: 500 ml) por la frecuencia
respiratoria (FR: 15x´), se obtiene el volumen global ventilado en 1 minuto que, por
recolectarse usualmente en espiración, se designa como volumen espiratorio por
minuto o  E (el punto sobre
la V significa "por unidad de tiempo"). La parte de esta ventilación que queda
en el VEM se calcula multiplicando este último por la FR. El volumen minuto neto que llega a los alvéolos funcionantes y
toma parte en el intercambio gaseoso se denomina ventilación alveolar (
E (el punto sobre
la V significa "por unidad de tiempo"). La parte de esta ventilación que queda
en el VEM se calcula multiplicando este último por la FR. El volumen minuto neto que llega a los alvéolos funcionantes y
toma parte en el intercambio gaseoso se denomina ventilación alveolar (  A).
A).
Los Gases se
disuelven en los líquidos. La Sangre, por tanto, contiene GASES DISUELTOS. Pero los Gases de la Sangre que se
analizan con la Gasometría no son sólo los disueltos; también
los relacionados con los componentes químicos de la Sangre, tales como
el Monóxido de Carbono y el Oxígeno que se unen a los Glóbulos Rojos.
TRANSPORTE DE OXÍGENO
El consumo de oxígeno en reposo de un individuo normal es
alrededor de 250 ml/minuto (a razón de 15 incursiones por minuto arroja la
cifra de 3,750 litros/minuto); y en ejercicio intenso puede aumentar más de 10
veces.
El oxígeno atmosférico es la FUENTE del oxígeno que se
consume al nivel de las MITOCONDRIAS y llega a los alvéolos por efecto de la ventilación. De allí difunde a la
sangre del capilar pulmonar y es
transportado a las células por el aparato
circulatorio.
El Oxígeno SE DISUELVE físicamente EN EL PLASMA, mas del 99%
del gas es transportado en combinación química POR LA HEMO-GLOBINA (Hb) de los glóbulos rojos.
Antes de entrar al análisis de estos fenómenos definiremos
algunos términos usados para referirse al oxígeno en la sangre.
Presión parcial de oxígeno (PO2).- Las
moléculas del oxígeno disuelto en la sangre ejercen una presión, que puede ser
medida en clínica con relativa facilidad con electrodos especiales y se
expresan en milímetros de mercurio (mmHg).
-En la sangre capilar
pulmonar, la presión de oxígeno capilar (PcO2) está determinada
por la presión
alveolar de oxígeno (PAO2).
-En la sangre
arterial, la presión de oxígeno arterial (PaO2) es más baja
que en el capilar pulmonar por efecto de la admisión venosa anatómica y
funcional.
Como en las arterias no hay intercambio gaseoso, la
presión de oxígeno es la misma en todas las arterias y su valor es un
índice del estado de la función captadora de oxígeno del pulmón.
En el territorio
venoso, la presión de oxígeno (PvO2) cae por el paso
de oxígeno de los capilares a los tejidos. Como existe una variación
considerable en el consumo de oxígeno de los distintos órganos, la presión de
oxígeno en la sangre venosa que sale de cada órgano es distinta: el miocardio
extrae casi todo el oxígeno que le llega, mientras que la piel utiliza muy poco
y los grupos musculares en actividad extraen mucho más que los que están en
reposo.
CONTENIDO DE OXÍGENO: Es el volumen de O2 contenido en un
decilitro(dl) de sangre. Está determinado por la PRESIÓN PARCIAL de 02
y por la cantidad de HEMO-GLOBINA de la sangre e indica la eficacia con que la
sangre cumple su rol transportador.
*En condiciones normales en reposo
la sangre arterial lleva alrededor de 900 ml de oxigeno por minuto a los
tejidos.
CAPACIDAD DE OXÍGENO: Cantidad máxima de 02 que puede ser transportada
en 100 ml de sangre expuesta directamente al aire ambiental, fuera del
organismo.
DEPENDE básicamente de la cantidad de HEMO-GLOBINA, que es
capaz de transportar 1,34 mililitro (ml) de oxígeno por cada gramo. 15 gramos
de Hemo-globina contenidos en 100 ml de sangre, arroja la cantidad de 20
mililitros (ml).
SATURACIÓN DE OXÍGENO: Normalmente, con una presión
parcial de O2 alveolar de 80-90
milímetro de mercurio (Mg.) la saturación
arterial de oxígeno (SaO2) es de
94-97%. La
HEMO-GLOBINA sólo se satura al 100% cuando la presión de O2 está por
encima de los 240 mmHg de presión parcial.
En consecuencia, siempre existirá un porcentaje de Hemo-globina no
saturada. Hay que tener en cuenta que los
actuales equipos de gases sólo lo “calculan”, no lo miden, cosa que sí puede
hacerse con un Oxímetro transcutáneo con bastante precisión.
EJEMPLOS:
-Un sujeto normal, con 15 g Hb/dl, tiene una
capacidad de oxígeno de 20,1 ml.
Con una presión arterial de oxígeno de 90 mmHg se logra
una saturación de 97,5%, lo que significa un contenido de 19,59 ml. Si a este sujeto se le administra
oxígeno puro, la presión de oxígeno sube de 500 mmHg, con lo que la Hb se
satura completamente, agregándose 0,51 ml de oxígeno ligado a la Hb por cada
100 ml de sangre. El oxígeno disuelto, que guarda una relación lineal con la
presión parcial, aumenta a 1,5 ml, con lo que el aumento total en el oxígeno
transportado es sólo de 2,3 ml. Es importante notar que un aumento de 500% en
la presión parcial de oxígeno cuando la Hb está normalmente saturada solo
significa un aumento del orden del 10% en el contenido de oxígeno y esto,
principalmente, a través de aumentar el oxígeno disuelto.
-Un sujeto con pulmón
normal y, por lo tanto, una PaO2
normal de 90 mmHg si tiene una anemia de 10 grs. de Hb/dl tendrá una capacidad de solo 13,4 ml que, con una saturación de 97,5%, determina
un contenido reducido de 13 ml de oxígeno por 100 ml de sangre. La respuesta a
la administración de oxígeno 100% será casi igual que en el individuo sin
anemia, ya que su Hb disminuida está altamente saturada y lo que aumenta es el
oxígeno en disolución. En resumen, en este caso tenemos una presión parcial de
oxígeno normal, ya que el pulmón está sano, con un contenido bajo porque la
capacidad es baja.
-Un paciente con un
trastorno pulmonar que BAJA su presión alveolar (Pa) de oxígeno de
90 a 40 mmHg tendrá un contenido de mas o
menos 10 ml/dl, ya que su Hb de 15 grs. se satura sólo en un 50%. En este caso
el problema no es de transporte sino de oferta pulmonar de O2.
TRANSPORTE DE OXÍGENO COMBINADO CON LA HEMOGLOBINA.-
La Hemo-Globina
actúa como un VEHÍCULO que se carga de
oxígeno en los capilares pulmonares y lo TRANSPORTA a los tejidos.
El O2 se transporta unido al HIERRO (F ++) y cada molécula de
Hb tiene 4 iones Fe ++, cada molécula de Hb transporta 4 moléculas
de O2, en forma de un compuesto lábil de oxihemoglobina.
La Hb es una PROTEÍNA del glóbulo rojo, compuesta por la globina y cuatro grupos Heme.
El grupo Heme está constituido por 4 núcleos pirrólicos que tienen en un núcleo
central el Fe++.
El grado de saturación de la Hb con oxígeno varía con la PaO2
en el plasma. La CURVA que expresa esta relación (curva de disociación de la
Hb) SE CONSTRUYE sometiendo muestras de sangre a presiones de oxígeno
crecientes manteniendo constantes la temperatura (37oC) y la PaCO2
(40 mmHg). Luego se mide la cantidad de O2 unida a la Hb a las
distintas presiones y se dibuja en un gráfico con la saturación en la ordenada
y la presión parcial en la abscisa.
La curva de disociación de la Hb tiene aproximadamente la
forma de “S” itálica en la cual se distingue una porción de pendiente
pronunciada, que corresponde a las presiones de O2
más bajas (<60mmHg) y una zona aplanada en relación con las presiones de O2 más altas (>70
mmHg). Entre estas dos porciones existe una zona de transición ubicada
alrededor entre 60
y 70 mmHg de PO2.
Esta forma de la curva es de gran importancia fisiológica:
en la porción casi vertical, pequeños cambios de la
PaO2 causan cambios importantes
en la saturación y, por lo tanto, en el contenido de oxígeno. El
intercambio de oxígeno tisular se realiza en esta porción y la Hb, al encontrar
bajas presiones tisulares de O2, entrega grandes cantidades de
oxígeno.
Por el contrario, en la porción casi horizontal, grandes
cambios de PO2 apenas modifican el contenido de oxígeno de la
sangre, lo que explica que aun cuando la PaO2 normal
varía entre 90 y 65 mmHg según la edad, el contenido normal de oxígeno cambia
muy poco. Por la misma razón puede existir una
alteración de la función pulmonar con caída importante de la PaO2,
sin que se produzca desaturación arterial;
pero si la PaO2 baja más allá de la zona de transición
(<60 mmHg) el contenido de O2 puede descender rápidamente.
¿CÓMO SE UNEN ESOS GASES A LOS GLÓBULOS ROJOS?
El Monóxido de Carbono, también denominado óxido de
carbono (II), gas carbonoso y anhídrido carbonoso (los dos últimos cada vez más
en desuso) cuya fórmula química es CO2, es un GAS inodoro, incoloro,
inflamable y altamente TÓXICO.
TRANSPORTE DE CO2.-
El CO2 se produce a nivel de las mitocondrias, como PRODUCTO
final del METABOLISMO celular. Desde las mitocondrias atraviesa el citoplasma,
PASA A LA SANGRE en los capilares tisulares y ES LLEVADO POR LA SANGRE AL ALVEOLO,
tanto en combinaciones químicas como en solución física, desde donde SE ELIMINA
a la atmósfera gracias a la VENTILACIÓN ALVEOLAR.
Debido a que el CO2 tiene la propiedad de
hidratarse, FORMANDO ÁCIDO CARBÓNICO en una reacción reversible, EL TRANSPORTE
de CO2 y su eliminación son PARTE FUNDAMENTAL del equilibrio
ácido-base. La cantidad total de CO2 en la sangre arterial es de
aproximadamente 48 volúmenes en 100 ml de sangre.
¿CÓMO SE REALIZA ESE TRANSPORTE EN EL PLASMA?
En tres
formas:
UNA.- Parte se
mantiene DISUELTA físicamente en el plasma, dependiendo de la Presión parcial
de CO2 y de su coeficiente de solubilidad.
DOS.- Otra parte forma
compuestos carbamínicos con las proteínas plasmáticas en una reacción rápida
que no requiere de catalizador:
R-NH2 + CO2
R-NHCOO- + H+
(R-NH2 son compuestos orgánicos nitrogenados que provienen de la sustitución de los hidrogeniones -H- de un amoniaco -NH3- por radicales alquilo)
TRES.- Una pequeña
cantidad reacciona con el agua para formar ácido carbónico e implicarse en el
equilibrio ácido-base:
CO2 (anhídrido carbónico) + H2O (agua): HCO3- (ácido carbónico/bicarbonato) H+ (hidrogenión) + HCO3-
TRANSPORTE POR EL GLÓBULO ROJO.- La mayor
parte del CO2, que difunde DESDE LOS TEJIDOS HACIA LOS CAPILARES,
entra al glóbulo rojo, donde se transporta en las siguientes formas:
- Una pequeña fracción permanece DISUELTA en el líquido
DENTRO DEL GLÓBULO.
- Parte del CO2 se
combina con los grupos amino de la hemoglobina para formar compuestos
carbamínicos.
- La mayor parte del CO2 que penetra al glóbulo
rojo a nivel tisular se hidrata, como en el plasma -pero a mayor velocidad-, ya
que en el Eritrocito existe una alta concentración de la enzima anhidrasa
carbónica que cataliza la reacción.
CATÁLISIS: es el
proceso por el cual se aumenta o disminuye la velocidad de una REACCIÓN
QUÍMICA, debido a la participación de una sustancia llamada catalizador.
Las sustancias que REDUCEN la velocidad de la reacción son
denominados «CATALIZADORES negativos» o «INHIBIDORES». A su vez, las sustancias
que AUMENTAN la actividad de los catalizadores son denominados «catalizadores
positivos» o «PROMOTORES», y las que desactivan la catálisis son denominados
venenos catalíticos.
El Bicarbonato (HCO3-) que se forma SE
DISOCIA en Hidrógeno (H+)
y Bicarbonato (HCO3-).
Los iones H+ son CAPTADOS por la HEMOGLOBINA (hemo-globina) y los
aniones HCO3- SALEN DEL GLÓBULO ROJO hacia el plasma,
donde la concentración de este ión es menor, intercambiándose por el anión
Cloro (efecto Hamburger).
Al entregar Oxígeno (O2) la Hemoglobina (Hb) OXIGENADA se transforma en Hb REDUCIDA, que, por ser un ácido débil, tiene poder tamponador de H+. Con ello aumenta la capacidad de transporte de CO2 (efecto Haldane). De este modo, LA ENTREGA de O2 y la captación de CO2 QUE TIENEN LUGAR EN LOS CAPILARES sistémicos, son DOS PROCESOS que se favorecen mutuamente: un AUMENTO de la presión de CO2 en la sangre capilar, con la consiguiente DISMINUCIÓN del pH, que facilita la entrega de O2 (efecto Bohr), a la par que el AUMENTO de Hb reducida facilita la captación de CO2 (efecto Haldane).
En los pulmones, la PCO2 alveolar (40 mmHg) es menor que la PCO2 de la sangre venosa (46 mmHg) y las reacciones antes descritas se desplazan hacia la izquierda debido a que parte del CO2 difunde desde la sangre al alvéolo. Al mismo tiempo, la Hb reducida se oxigena, transformándose en un ácido más fuerte, lo que significa liberar CO2 del glóbulo rojo.
Al entregar Oxígeno (O2) la Hemoglobina (Hb) OXIGENADA se transforma en Hb REDUCIDA, que, por ser un ácido débil, tiene poder tamponador de H+. Con ello aumenta la capacidad de transporte de CO2 (efecto Haldane). De este modo, LA ENTREGA de O2 y la captación de CO2 QUE TIENEN LUGAR EN LOS CAPILARES sistémicos, son DOS PROCESOS que se favorecen mutuamente: un AUMENTO de la presión de CO2 en la sangre capilar, con la consiguiente DISMINUCIÓN del pH, que facilita la entrega de O2 (efecto Bohr), a la par que el AUMENTO de Hb reducida facilita la captación de CO2 (efecto Haldane).
En los pulmones, la PCO2 alveolar (40 mmHg) es menor que la PCO2 de la sangre venosa (46 mmHg) y las reacciones antes descritas se desplazan hacia la izquierda debido a que parte del CO2 difunde desde la sangre al alvéolo. Al mismo tiempo, la Hb reducida se oxigena, transformándose en un ácido más fuerte, lo que significa liberar CO2 del glóbulo rojo.
Simultáneamente, el Bicarbonato (HCO3-)
del plasma entra al Eritrocito donde forma H2CO3, que SE
DISOCIA en CO2 y H2O
en presencia de la enzima anhidrasa carbónica (de ahí la importancia del número
de ERITROCITOS; o lo que es igual, de ANEMIA, que influirá tanto en el pH como
en la cantidad de Oxígeno -02- en la sangre).
El CO2
formado difunde a través de la membrana del Eritrocito al plasma, atraviesa la
membrana alvéolo-capilar y es eliminado
con la ventilación.
Aunque el CO2 es un RESIDUO, el metabolismo que
el organismo debe eliminar, en su camino
hacia la atmósfera es un determinante crucial del control de la ventilación
y del Equilibrio ÁCIDO-BASE.
RESPIRACIÓN CELULAR.-
Es el conjunto de reacciones bioquímicas por las cuales determinados compuestos
orgánicos son degradados completamente, por OXIDACIÓN, hasta su conversión en
sustancias inorgánicas, proceso que rinde energía (en forma de ATP) aprovechable
por la CÉLULA.
Los SUBSTRATOS habitualmente
usados en el proceso son la GLUCOSA, otros HIDRATOS de Carbono, Ácidos grados,
incluso AMINOÁCIDOS, Cuerpos cetónicos u otros compuestos orgánicos.
La respiración celular, como componente del METABOLISMO, es
un proceso CATABÓLICO, en el cual la energía contenida en los SUBSTRATOS usados
como combustible es liberada de manera controlada. Durante la misma, buena
parte de la energía libre desprendida en estas reacciones exotérmicas es
incorporada a la molécula de ATP (o de nucleótidos trifosfato equivalentes),
que puede ser a continuación utilizada en los procesos endotérmicos, como son
los de mantenimiento y desarrollo celular (ANABOLISMO).
ACIDOSIS Y ALCALOSIS.-
La concentración de hidrogeniones (H+) en los
líquidos del organismo es una de las variables biológicas más estrechamente
controladas. Esto se debe a que la producción de estos iones por el metabolismo
es cuantiosa, a la par que cambios relativamente pequeños en su concentración
pueden producir trastornos graves en múltiples órganos y enzimas:
-Un AUMENTO en la concentración de H+, que se
traduzca por una caída del pH por bajo de 7,20, produce:
*depresión del SNC,
*disminución de la contractilidad cardíaca,
*disminución de la respuesta inotrópica miocárdica a
catecolaminas,
*hiperkalemia,
*arritmias,
*etc.
-Una DISMINUCIÓN, si cae a 6,9, es incompatible con la vida.
Un pH sobre 7,55 causa serios trastornos y sobre 7,8 lleva a
la muerte.
El Equilibrio ácido-básico es un proceso complejo en el cual
participan múltiples órganos para mantener relativamente constantes una serie
de balances interrelacionados, tales como: pH, equilibrio eléctrico, equilibrio
osmótico y volemia.
Si se producen cambios en alguno de estos elementos, la
respuesta del organismo será tratar de volverlos a sus límites normales,
afectando en un mínimo a otros equilibrios.
ALTERACIONES EN EL DESEQUILIBRIO ÁCIDO-BASE PUEDEN ESTAR
PRESENTES EN MUCHAS ENFERMEDADES.
Estos trastornos suelen ser una manifestación de una
enfermedad subyacente.
RESULTADOS DE LOS GASES Y TRASTORNOS:
PROBLEMA PULMONAR (respiratorio) o los riñones (metabólico).
Y si la sangre es demasiado ácida (acidosis) o demasiado alcalina (alcalosis).
- Acidosis RESPIRATORIA: el CO2 no pueda salir del cuerpo. En la sangre, AUMENTA la concentración de CO2 y el pH disminuye. Las posibles causas incluyen la enfermedad pulmonar obstructiva crónica (EPOC) o la neumonía.
- Acidosis RESPIRATORIA: el CO2 no pueda salir del cuerpo. En la sangre, AUMENTA la concentración de CO2 y el pH disminuye. Las posibles causas incluyen la enfermedad pulmonar obstructiva crónica (EPOC) o la neumonía.
La acidosis respiratoria puede ser aguda o crónica.
*Acidosis Respiratoria Aguda: la PaCO2 se encuentra elevada, por encima del límite superior del rango de referencia normal (más de 45 mmHg) con una concomitante acidemia (pH < 7,35).
*Acidos Respiratoria Crónica: la PaCO2 se encuentra también elevada, por encima del límite superior del rango normal, pero persiste en el tiempo con un pH sanguíneo normal (7,35 a 7,45) o valores casi normales gracias a la compensación renal y a nieveles elevados de Bicarbonato (HCO-3 > 30 mEq/L).
La acidosis respiratoria es uno de los trastornos del Equilibrio Ácido-Base en la que la disminución en la frecuencia de las respiraciones o HIPOVENTILACIÓN, provoca una concentración creciente del DIÓXIDO DE CARBONO en el plansma sanguíneo y la consecuente DISMINUCIÓN del pH de la sangre.
El Dióxido de Carbono es producido constantemente a medida que el cuerpo metaboliza energía, el cual se acumulará en la circulación con rapidez si los pulmones no lo eliminan adecuadamente. La hipoventilación alveolar conduce así a un AUMENTO de la PRESIÓN PARCIAL de CO2 arterial (PaCO2), un trastorno llamado HIPERCPANIA (el valor normal de la PaCO2 es de 36-44 mm Hg). El aumento en la PaCO2, a su vez, disminuye la relación entre el bicarbonato (HCO3 y la PaCO2 con la consecuente disminución en la acidez o pH sanguíneo.
*Acidosis Respiratoria Aguda: la PaCO2 se encuentra elevada, por encima del límite superior del rango de referencia normal (más de 45 mmHg) con una concomitante acidemia (pH < 7,35).
*Acidos Respiratoria Crónica: la PaCO2 se encuentra también elevada, por encima del límite superior del rango normal, pero persiste en el tiempo con un pH sanguíneo normal (7,35 a 7,45) o valores casi normales gracias a la compensación renal y a nieveles elevados de Bicarbonato (HCO-3 > 30 mEq/L).
La acidosis respiratoria es uno de los trastornos del Equilibrio Ácido-Base en la que la disminución en la frecuencia de las respiraciones o HIPOVENTILACIÓN, provoca una concentración creciente del DIÓXIDO DE CARBONO en el plansma sanguíneo y la consecuente DISMINUCIÓN del pH de la sangre.
El Dióxido de Carbono es producido constantemente a medida que el cuerpo metaboliza energía, el cual se acumulará en la circulación con rapidez si los pulmones no lo eliminan adecuadamente. La hipoventilación alveolar conduce así a un AUMENTO de la PRESIÓN PARCIAL de CO2 arterial (PaCO2), un trastorno llamado HIPERCPANIA (el valor normal de la PaCO2 es de 36-44 mm Hg). El aumento en la PaCO2, a su vez, disminuye la relación entre el bicarbonato (HCO3 y la PaCO2 con la consecuente disminución en la acidez o pH sanguíneo.
- Alcalosis RESPIRATORIA:
Taquipnea, o aumento de la respiración, provoca más eliminación de CO2,
lo que permite que la concentración de CO2 en sangre disminuya y el pH aumente. Las posibles causas incluyen
hiperventilación, dolor y ciertas enfermedades pulmonares.
- Acidosis METABÓLICA: disminución del pH (menos de 7,35) y de la concentración de bicarbonato (HCO3-) en la sangre. Las posibles causas incluyen una Diabetes mellitus no regulada y problemas renales graves.
- Acidosis METABÓLICA: disminución del pH (menos de 7,35) y de la concentración de bicarbonato (HCO3-) en la sangre. Las posibles causas incluyen una Diabetes mellitus no regulada y problemas renales graves.
- Alcalosis METABÓLICA: aumento del pH (por encima de 7,45), con un aumento de la concentración de bicarbonato (HCO3-) en la sangre. La posible causa son los VÓMITOS prolongados.
MANTENCION DEL EQUILIBRIO ACIDO-BASE
En condiciones normales, la producción y eliminación de HIDROGENIONES (H+) están muy
equilibradas, de manera que el pH se mantiene casi constante.
Aunque la producción de H+ aumente marcadamente,
como sucede en el ejercicio, el organismo logra mantener una concentración de
hidrogeniones (H+) relativamente estable gracias a la existencia de
mecanismos TAMPONES y a la acción reguladora del aparato RESPIRATORIO y
del RIÑÓN.
SOLUCIONES TAMPON.
Mezcla de sustancias químicas que limitan las variaciones del pH, producidas al agregarse un ácido o una base. Generalmente están formadas por la combinación de un ácido débil y una sal del mismo.
Uno de los tampones más importantes del organismo es la
mezcla de ácido carbónico y bicarbonato de sodio.
Supongamos que agregamos un ácido fuerte, por ejemplo HCl, a
esta solución tampón:
HCl + Na HCO3
|
Na+
+ H++ Cl - + HCO3-
|
|
NaCl
+ H2CO3
|
En esta ecuación simplificada se puede observar que el ácido
clorhídrico (HCl),
como ácido fuerte, libera muchos aniones H, que debieran hacer caer el pH
marcadamente, pero esto no sucede porque los hidrogeniones se combinan con el
anión bicarbonato (HCO3-)
formando
ácido carbónico, que es un ácido débil.
Esto se debe a que se produce una competencia por los
hidrogeniones entre la base débil Cl y la base fuerte HCO3-.
Este sistema tampón es más eficaz en el organismo que in
vitro, ya que el H2CO3 formado se desdobla, en parte, en
H2O y CO2, y este último gas es eliminado rápidamente a
través de la ventilación que aumenta en la medida que aumenta el CO2.
Con ello la reacción sigue funcionando hacia la derecha con mayor
neutralización del HCl o de cualquier otro ácido fijo.
El tampón H2CO3/Na HCO3-
no es el único del organismo, pero como se equilibra casi instantáneamente con
los demás (proteínas, fosfatos, hemoglobina, etc,) el estado ácido-base global
es reflejado por este tampón, cuya medición es relativamente fácil.
ROL DEL APARATO RESPIRATORIO.- Dispone de SENSORES exquisitamente sensibles a las variaciones de pH:
-pH aumentado: determina
un aumento de la Ventilación, para eliminar mayor cantidad CO2, para mantener constante el pH. Ocurre por la
producción de ÁCIDO LÁCTICO, por ejemplo, en el ejercicio.
-pH disminuido:
deja de estimular la ventilación.
Lo valioso de este mecanismo en su rapidez, pero es limitado
porque la ventilación tiene también otras exigencias que cumplir.
ROL DEL RIÑON.- Participa en la REGULACIÓN del
equilibrio ácido básico por dos mecanismos principales:
-Por una parte,
es capaz de regular la cantidad de Bicarbonato (HCO3) urinario, ya
que puede excretar los excesos de este ión o reabsorber el bicarbonato filtrado.
-Por otra parte,
el Riñón es capaz de excretar hidrogeniones en la forma de Ácido fosfórico (H3PO4)
o de Amoniaco –Amonio- (NH4+).
Durante este proceso se genera nuevo Bicarbonato (HCO3),
lo que hace posible el reemplazo de aquel que se consumió al tamponar los
ácidos fijos.
-Acidemia: aumentar la excreción urinaria de hidrogeniones (H) y la retención de Bicarbonato (HCO3);
-Alcalemia: tiene los efectos contrarios:
aumenta excreción de Bicarbonato; retiene hidrogeniones.
Estas funciones compensatorias son lentas, ya que demoran
entre 12 y 72 horas en alcanzar su máxima eficiencia. Por lo tanto, el riñón
participa en la mantención del equilibrio ácido-básico a largo plazo.
